Titrasi Asam Basa, Macam-macam Kurva dan Rumusnya
- Ruang Guru
VIVA – Titrasi asam basa adalah penentuan kadar suatu larutan basa dengan larutan asam yang diketahui kadarnya. Atau sebaliknya, penentuan kadar suatu larutan asam dengan larutan basa yang diketahui, dengan didasarkan pada reaksi netralisasi. Titrasi harus dilakukan hingga mencapai titik ekivalen, yaitu keadaan saat asam dan basa tepat habis bereaksi secara stoikiometri. Titik ekivalen umumnya dapat ditandai dengan perubahan warna dari indikator. Sementara itu, keadaan saat titrasi harus dihentikan tepat pada saat indikator menunjukkan perubahan warna disebut titik akhir titrasi.
Untuk memperoleh hasil titrasi yang tepat, maka selisih antara titik akhir titrasi dengan titik ekivalen harus diusahakan seminimal mungkin. Hal ini dapat diupayakan dengan memilih indikator yang tepat pada saat titrasi, yakni indikator yang mengalami perubahan warna atau trayek pH di sekitar titik ekivalen.
Sebagai contoh, pada label botol cuka makan umumnya terdapat informasi kadar cuka. Jika pada suatu botol cuka tertulis 25% asam cuka, bagaimana cara memastikan kebenaran kadar yang tertera tersebut?
Nah, penentuan kadar asam cuka dapat dilakukan dengan prosedur eksperimen menggunakan metode titrasi asam basa, Sobat Pintar.
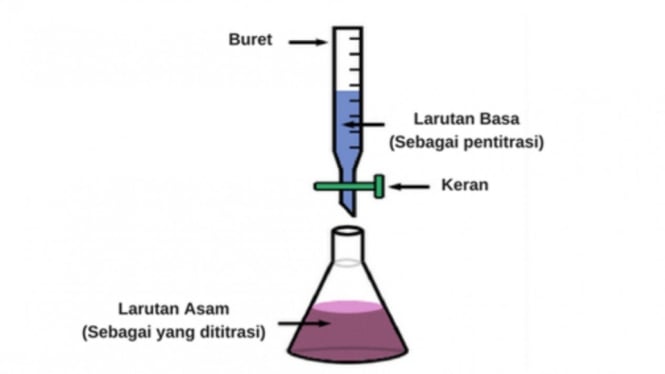
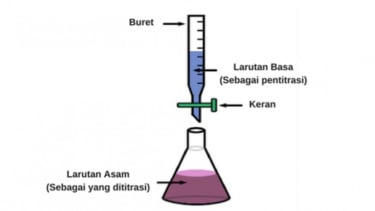
Prosedur titrasi asam basa
1. Asam yang akan dititrasi dimasukkan dalam erlenmeyer, kemudian ditetesi indikator asam-basa yang sesuai dengan trayek pH.
2. Masukkan pentiter basa dimasukkan ke dalam buret, dan ditambahkan dalam erlenmeyer setetes demi setetes sambil menghitung berapa volume yang dibutuhkan.
3. Ketika warna indikator berubah, hentikan titrasi (titik akhir titrasi)
Perubahan pH pada Titrasi Asam Basa
Pada saat larutan basa ditetesi dengan larutan asam, pH larutan akan turun. Sebaliknya, jika larutan asam ditetesi dengan larutan basa, maka pH larutan akan naik. Jika pH larutan asam atau basa diplotkan sebagai fungsi dari volum larutan basa atau asam yang diteteskan, maka akan diperoleh suatu grafik yang disebut kurva titrasi.
Kurva titrasi asam basa menunjukkan perubahan pH larutan selama proses titrasi asam dengan basa, atau sebaliknya. Bentuk kurva titrasi memiliki karakteristik tertentu yang bergantung pada kekuatan dan konsentrasi asam dan basa yang bereaksi.
Mengenal Macam-Macam Kurva Titrasi Asam Basa
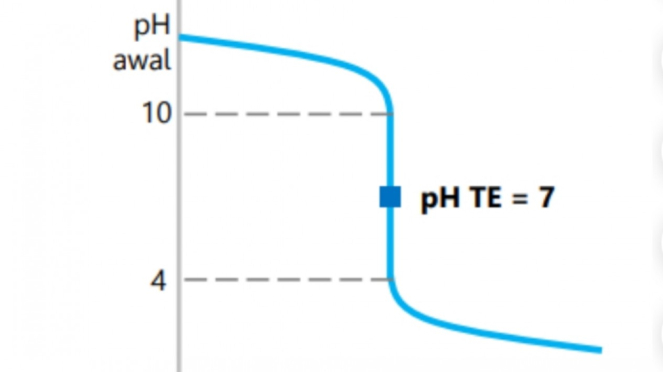
Titrasi asam kuat dengan basa kuat
Titrasi asam kuat dengan basa kuat
- Aku Pintar
- Zat pentiter adalah basa kuat.
- Daerah perubahan pH drastis 4 – 10.
- pH titik ekuivalen 7.
- Indikator yang dapat digunakan adalah metil merah, bromtimol biru, dan fenolftalein (lebih tajam).
- Contoh: HCl dengan NaOH.
Titrasi basa kuat dengan asam kuat
Titrasi basa kuat dengan asam kuat
- Aku Pintar
- Zat pentiter adalah asam kuat.
- Daerah perubahan pH drastis 4 – 10.
- pH titik ekuivalen 7.
- Indikator yang dapat digunakan adalah metil merah, bromtimol biru, dan fenolftalein (lebih tajam).
- Contoh: NaOH dengan HCl.
Titrasi asam kuat dengan basa lemah
Titrasi asam kuat dengan basa lemah
- Aku Pintar
- Zat pentiter adalah basa lemah.
- Daerah perubahan pH drastis 4 – 7.
- pH titik ekuivalen 5 – 6.
- Indikator yang dapat digunakan adalah metil merah.
- Contoh: HCl dengan NH4OH.
Titrasi basa lemah dengan asam kuat
Titrasi basa lemah dengan asam kuat
- Aku Pintar
- Zat pentiter adalah asam kuat.
- Daerah perubahan pH drastis 4 – 7.
- pH titik ekuivalen 5 – 6.
- Indikator yang dapat digunakan adalah metil merah.
- Contoh: NH4OH dengan HCl.
Titrasi basa kuat dengan asam lemah
Titrasi basa kuat dengan asam lemah
- Aku Pintar
- Zat pentiter adalah asam lemah.
- Daerah perubahan pH drastis 7 – 10.
- pH titik ekuivalen 8 – 9.
- Indikator yang dapat digunakan adalah fenolftalein.
- Contoh: NaOH dengan CH3COOH.
Titrasi asam lemah dengan basa kuat
Titrasi asam lemah dengan basa kuat
- Aku Pintar
- Zat pentiter adalah basa kuat.
- Daerah perubahan pH drastis 7 – 10.
- pH titik ekuivalen 8 – 9.
- Indikator yang dapat digunakan adalah fenolftalein.
- Contoh: CH3COOH dengan NaOH.
Titrasi asam lemah menggunakan basa lemah dan sebaliknya tidak dilakukan karena:
1. Perubahan drastis pH terjadi sangat singkat.
2. Tidak ada indikator yang cukup teliti untuk mengamati perubahan.
3. Reaksi berlangsung lambat dan tidak tuntas.
Rumus Titrasi Asam Basa
Rumus titrasi asam basa yang digunakan untuk menentukan konsentrasi asam/basa adalah sebagai berikut:
Rumus titrasi asam basa monovalen
- Aku Pintar
Jika larutan asam basa bukan merupakan monovalen atau polivalen (valensi lebih dari 1), gunakan rumus sebagai berikut:
Rumus titrasi asam basa polivalen
- Aku Pintar
Jenis Titrasi Asam Basa
Nah, pada materi titrasi asam basa, rumus dan perhitungannya ini, elo juga akan mengenal jenis titrasi asam basa.
Setidaknya ada ada dua jenis titrasi asam basa berdasarkan jenis zat terlarut dan larutan standarnya, yaitu titrasi alkalimetri dan titrasi asidimetri.
1. Titrasi Alkalimetri
Titrasi alkalimetri adalah titrasi menggunakan larutan standar berupa basa. Kalau elo tanya jenis titrasi apa yang umum digunakan, titrasi ini jawabannya,
Pada reaksi ini, ketika larutan standar yang digunakan adalah basa kuat dengan zat terlarut atau sampelnya adalah asam kuat, maka reaksi akhirnya akan menghasilkan pH netral.
Namun, jika larutan standarnya basa kuat dengan sampelnya adalah asam lemah, maka pH yang dihasilkan adalah >7 atau pH basa.
Contoh titrasi alkalimetri ini apa sih? Gue pakai contoh reaksi yang paling umum digunakan ya, yaitu reaksi antara HCl dengan NaOH.
Elo bisa menentukan kan mana yang asam dan mana yang basa? Nah, hasil dari reaksi ini merupakan reaksi penetralan, yaitu berupa garam dan air dengan pH netral.
HCl + NaOH → NaCl + H2O
2. Titrasi Asidimetri
Selanjutnya, ada titrasi asidimetri yang merupakan kebalikan dari alkalimetri. Titrasi asidimetri adalah titrasi yang menggunakan larutan standar berupa asam.
Pada titrasi jenis ini, ketika larutan asam kuat dititrasi dengan basa kuat, maka akan menghasilkan pH netral. Namun, jika larutan asam kuat dititrasi dengan basa lemah, maka hasilnya akan pH < 7 atau bersifat asam.
Contoh titrasi asidimetri ini terjadi pada larutan amonium hidroksida (NH4OH) yang termasuk basa lemah dititrasi dengan larutan asam klorida (HCl) yang termasuk asam kuat.
NH4OH + HCl → NH4Cl + H2O
Metode
Pemilihan indikator
Sebelum memulai titrasi indikator asam-basa yang sesuai harus ditentukan. Titik ekivalen reaksi, keadaan di mana sejumlah ekivalen reaktan telah bereaksi, akan memiliki pH yang bergantung pada kekuatan relatif asam dan basa yang digunakan. Nilai pH pada titik ekivalen dapat diestimasi menggunakan aturan berikut:
- Asam kuat akan bereaksi dengan basa kuat membentuk larutan netral (pH = 7).
- Asam kuat akan bereaksi dengan basa lemah membentuk larutan asam (pH < 7).
- Asam lemah akan bereaksi dengan basa kuat membentuk larutan basa (pH > 7).
Ketika suatu asam lemah bereaksi dengan basa lemah, larutan pada titik ekivalen akan bersifat basa jika kebasaannya cukup kuat serta bersifat asam jika keasamannya cukup kuat. Jika keduanya sama kuat, maka pH ekivalen akan netral. Tetapi, asam lemah tidak selalu ditirasi dengan basa lemah karena perubahan warna yang ditunjukkan oleh indikator terkadang sangat cepat, sehingga karenanya sangat sulit bagi pengamat untuk melihat perubahan warna tersebut.
Keadaan di mana indikator mengalami perubahan warna disebut sebagai titik akhir titrasi. Suatu indikator yang sesuai harus dipilih, lebih disukai indikator yang akan mengalami perubahan warna (titik akhir titrasi) yang terdekat dengan titik ekivalen titrasi. Titrasi asam-basa dilakukan dengan indikator bromotimol biru, untuk titrasi asam kuat-asam lemah, indikator fenolftalein pada titrasi asam lemah - basa kuat, dan metil jingga untuk titrasi asam kuat - basa lemah. Jika basa berada di luar rentang pH indikator-indikator tersebut, misalnya basa dengan pH >13.5, dan asam dengan pH >5.5, dapat digunakan indikator Alizarin kuning. Sementara itu, jika asam di luar rentang pH, misalnya pH <0.5, dan basa dengan pH <8.5, indikator Timol biru dapat digunakan.
Tahapan titrasi
- Pertama, buret harus dibilas dengan larutan standar, pipet larutan yang tidak diketahui konsentrasinya, dan dimasukkan ke dalam buret tersebut.
- Kedua, larutan dengan konsentrasi yang belum diketahui dengan sejumlah volume tertentu harus diambil dengan pipet ukur dan ditempatkan ke dalam labu erlenmeyer, bersama dengan sejumlah kecil indikator yang telah dipilih.
- Larutan yang telah diketahui konsentrasinya kemudian harus dikeluarkan dari buret, ke dalam labu erlenmeyer. Pada tahap ini perkiraan kasar jumlah larutan dibutuhkan untuk menetralisasi larutan dengan konsentrasi yang belum diketahui. larutan dibiarkan keluar dari buret sampai indikator berubah warna dan nilai pada buret harus dicatat. Nilai tersebut dicatat sebagai volume (kasar) titrasi dan harus dikeluarkan dari perhitungan apapun.
- Setidaknya tiga kali titrasi (triplo) atau lebih harus dilakukan, agar lebih akurat, dengan mempertimbangkan kira-kira di mana titik akhir akan terjadi. Pembacaan awal dan akhir pada buret (sebelum memulai titrasi dan pada titik akhir, masing-masing) harus dicatat. Mengurangkan volume awal dari volume akhir akan menghasilkan jumlah titran digunakan untuk mencapai titik akhir. Titik akhir tercapai hanya ketika indikator berubah warna secara permanen.