Tujuan Titrasi Asam Basa Beserta Pengertian, Prinsip Hingga Rumus
- rumus.co.id
VIVA – Tujuan titrasi asam basa mungkin perlu diketahui bagi kamu yang mempelajari mata pelajaran Ilmu Pengetahuan Alam (IPA). Pada kali ini kita akan membahas mengenai apa itu titrasi mulai dari pengertiannya, tujuan, prinsip hingga rumus. Kamu bisa mempelajari dan memahami pembahasan ini sebagai pembelajaran untuk menyelesaikan soal titrasi. Simak penjelasan berikut ini mengenai titrasi yang lebih lengkap:
Pengertian Titrasi
Titrasi sendiri merupakan sebuah metode analisis kimia yang dilakukan secara kuantitatif yang bisa digunakan di laboratorium, melansir dari jurnal Kemdikbud. Metode titrasi ini berguna untuk menentukan konsentrasi suatu reaktan. Teknik ini juga disebut sebagai analisis volumetrik karena peran penting pengukuran volume dalam titrasi.
Salah satu bagian utama dari kimia analitik yakni adalah analisis titrimetri dan perhitungannya didasarkan pada hubungan kuantitatif reaksi-reaksi kimia. Reaksi kimia yang digunakan sebagai dasar titrasi menurut Raymond Chang adalah reaksi yang melibatkan asam kuat dan basa kuat, asam lemah dengan basa kuat dan asam kuat dan basa lemah.
Ada beberapa hal yang perlu diperhatikan pada titrasi asam basa diantaranya seperti larutan standar (larutan yang sudah diketahui konsentrasinya), indikator yang berfungsi untuk mengetahui titik akhir titrasi dan prosedur untuk menghitung konsentrasi larutan yang ditentukan.
Tujuan Titrasi Asam Basa
Tentu metode titrasi ini memiliki tujuan yakni untuk menentukan suatu zat dalam larutan dengan zat/larutan lain secara kuantitatif yang konsentrasinya telah diketahui melalui reaksi hingga mencapai titik stoikhiometri secara bertahap.
Tujuan titrasi asam basa juga untuk menentukan molaritas larutan yang dimana konsentrasinya tidak diketahui. Selain itu, juga digunakan untuk menentukan persentase dari massa zat terlarut dalam sebuah larutan tertentu.
Untuk menemukan kemurnian dari unsur-unsur kimia dan melakukan tes bagi aktivitas buffering titrasi asam basa ini juga bisa digunakan. Misalnya seperti tes gula darah, nutrisi, tes kehamilan, analisis air limbah dan pengujian air pada akuarium yang dilakukan dengan menggunakan aplikasi titrasi asam basa.
Prinsip Kerja Titrasi Asam Basa
Untuk melakukan metode titrasi ini ada baiknya untuk mengetahui terlebih dahulu prinsip kerja dari titrasi asam basa. Sifat zat perlu diketahui terlebih dahulu apakah bersifat asam atau basa dengan mengukur pH-nya dalam menentukan senyawa yang kadarnya tidak diketahui.
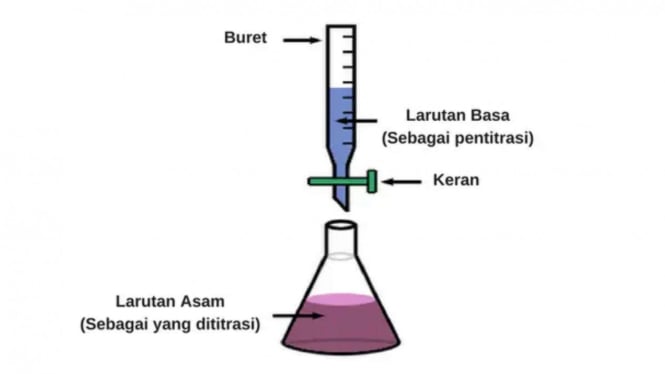
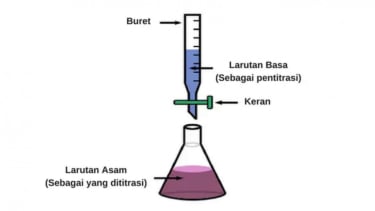
Setelah itu maka larutan (asam atau basa) yang akan digunakan untuk mentitrasi zat tersebut akan diukur kadarnya. Umumnya pada proses titrasi akan menggunakan alat berbentuk gelas yang disebut sebagai buret. Buret sendiri merupakan tabung yang secara vertikal telah dikalibrasi dan akan ditangguhkan dengan sumbat di bagian bawahnya.
Dengan menggunakan buret tersebut dalam titrasi, maka perubahan volume titran sebelum dan sesudah digunakan untuk titrasi dapat kita lihat. Konsentrasinya akan semakin tinggi apabila volume titran-nya semakin banyak digunakan.
Buret pada titrasi berfungsi untuk membantu mengatur aliran cairan ke dalam labu. Indikator pH nantinya akan berubah warna merah muda atau metil orange saat cairan mengalir ke dalam labu tersebut.
Dalam titrasi asam basa, secara perlahan zat yang akan diuji ditambahkan larutan yang kadarnya telah diketahui sehingga reaksi penetralan terjadi. Jika pH dalam larutan campuran tersebut netral, itu berarti semua zat sampel telah bereaksi dengan larutan yang digunakan untuk menitrasi.
Rumus Titrasi Asam Basa
Rumus Titrasi Asam Basa Manovalen/Divalen :
Ma . Va = Mb . Vb
Rumus Titrasi Asam Divalen dengan Basa Manovalen :
2Ma . Va = Mb . Vb
Rumus Titrasi Basa Divalen dengan Asam Manovalen :
Ma . Va = 2Mb . Vb
Contoh Soal Titrasi Asam Basa
1. Terdapat Larutan HCl 0,3 M, akan dititrasi dengan larutan NaOH, pada titik akhir titrasi tercapai bila 10 ml larutan HCl dan memerlukan 75 ml larutan NaOH :
a. Tentukan molaritas NaOH tersebut !
b. Tentukan Konsentrasi 20 ml Ca(OH)2 yang dititrasi dengan 100 ml larutan HCI 0,1 M!
Penyelesaian :
Diketahui :
Ma = 0,3 M
Va = 10 ml
Vb = 75 ml
nA = 1
nB = 1
Ditanya : Mb = ….?
Jawab soal a :
a. Mb = Va x Ma x nA/Vb x nB
Mb = 10 x 0,3 x 1/75 x 1
Mb = 0,04 M
Jadi, molaritas dari larutan tersebut adalah = 0,04 M
Jawab soal b :
b. = Va x Ma x nA = Vb x Mb nB
= 100 x 0,1 x 1 = 20 x Mb x 2
Mb = 100 x 0,1 x 1 : 40
Mb = 0,25 M
Jadi, konsentrasi dalam larutan tersebut adalah = 0,25 M
Itulah penjelasan mengenai pembahasan dari tujuan titrasi asam basa yang dilengkapi juga dengan pengertian, prinsip hingga rumusnya. Semoga tulisan ini dapat bermanfaat bagi kamu yang membutuhkannya.